¿Son hongos la causa de la esclerosis lateral amiotrófica y el alzheimer?
Número 210 - Diciembre 2017
Tiempo de lectura: 19 minutos
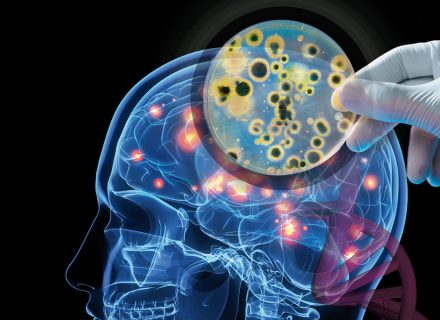
La esclerosis lateral amiotrófica (ELA) y el alzheimer podrían estar causadas por infecciones de hongos; al menos así se infiere de un reciente trabajo efectuado por un equipo del Centro de Biología Molecular Severo Ochoa coordinado por el catedrático de Microbiología Luis Carrasco cuyo trabajo acaba de publicarse en Neurobiology of Disease. Estas infecciones se han hallado en distintas regiones del sistema nervioso central de los 11 pacientes con ELA estudiados cuando tales hongos no aparecen en los cerebros de personas sanas. El trabajo constata así lo ya descubierto en 2015 por el mismo equipo al encontrar proteínas, DNA y unos corpúsculos intracelulares de varias especies de hongos en el cerebro y líquido cefalorraquídeo de esos enfermos; concretamente se ha detectado la presencia de Candida, Malassezia, Fusarium, Botrytis, Trichoderma y Cryptococcus.
Este texto solo está disponible para suscriptores.